

服务热线
138 2308 5206

news
新闻中心
干细胞技术,作为现代医学的前沿领域,需要我们以更全面、更理性的视角去审慎对待。我们必须严格遵守干细胞临床应用的相关指导原则和标准,以确保能够从中获得预期的治疗效果。
干细胞是一类能够自我更新、具有分化成一种或多种功能细胞类型的细胞。它具有自我复制、多向分化和归巢能力的特性,能够生成各种不同的体细胞类型,从而在医学领域发挥关键作用,被医学界称为“万能细胞”。
当讨论到干细胞治疗时,细胞的质量是不可避免的重要讨论点。很多人倾向于以回输的细胞数量作为评价干细胞质量的标准,认为细胞数量越多意味着疗效越好。
我国首个人源干细胞国家标准《生物样本库多能干细胞管理技术规范》(GB/T 42466-2023)(以下简称《规范》)在23年9月正式发布。《规范》涵盖了干细胞采集和接收、复苏和培养、冷冻与储存、质量控制等方面。这一国家标准的发布,标志着我国在干细胞样本库管理上有了标准技术支撑,对于干细胞技术的发展具有重要意义,也为干细胞领域后续相关标准的制定提供了先行示范。
其中在质量控制里,提到干细胞的验收标准可参考T/CSCB-0002与T/CSCB-0005的内容,其中影响质量的重要因素有三个,细胞来源、细胞存活率、细胞生长活性等。
细胞来源 为了确保干细胞的高品质,选择细胞的来源至关重要。随着人体的老化,细胞的活性也逐步下降。不论是采用他人捐赠的细胞进行异体移植,还是使用个体自身的细胞进行自体移植,供体的年龄和健康状况都会显著影响获得细胞的质量。 ▲人体骨髓中间充质干细胞随年龄的变化关系 ▲20岁的细胞数量 vs 70岁的细胞数量 ▲20岁的细胞活性 vs 70岁的细胞活性 2019年,英国利兹大学的科研团队就采集了67名健康供体(19-89岁)的骨髓间充质干细胞,通过体外培养的方式证实了:年轻人的干细胞数量和增殖能力显著高于老年人。 团队招募了19-89岁的67位捐献者进行外周血骨髓间充质干细胞分离。之后首先将捐献者的样本按照19-40岁、41-60岁和61-89岁分为三组,经过对比,结果如以下图所示,相同采血量所分离出的细胞数19-40岁年龄组明显高于另外两组,与之前报道的研究结果相符。 ⚫️代表男性 ⚪️代表女性 研究者从样本中分出19-37岁和61-76岁两个年龄组利用标准培养基进行培养,以相同时间每个细胞生长的细胞团的面积来评定细胞的增殖活力,结果如下图所示,年轻分组拥有较大生长面积的数目及总量明显多于年老分组,可见年轻细胞拥有更强的增殖能力。 ▲不同年龄组细胞生长活力对比 因此,从年龄这一因素出发,脐带、胎盘、羊膜等围产组织所提取的干细胞,因其出生即获取,故被昵称为“零岁细胞”,通常被认为是最佳选择。年轻成人的骨髓和脂肪干细胞也是较好的选择,因为它们相较于更老年龄段的细胞具有较高的活性和再生能力。对于年龄较大的个体,通常不推荐直接使用自体干细胞进行治疗,因为这些细胞的再生和修复潜能可能已经降低。 ▲年轻态的干细胞胞体饱满、呈明显的梭形;衰老的干细胞胞体宽大扁平 年轻态的MSC的典型特征就是增殖速度快、胞体饱满、立体感很好、呈明显的梭形、伪足较少;而衰老的MSC的典型特征就是增殖缓慢甚至停止、胞体宽大扁平,有时还出现胞体颗粒增多或者空泡增多。 此外,供者本身的身体状况也对干细胞有一定影响。 首先供体必须经过检验筛查证明无人源特定病毒(包括HIV、HBV、HCV、HTLV、EBV、CMV等)的感染,无梅毒螺旋体感染。其次除了病毒感染,许多疾病也会影响自体间充质干细胞的功能及效果,如遗传性疾病、自身免疫性疾病和部分慢性疾病等。 以常见的糖尿病为例,2021年9月刊登在《STEM CELLS TRANSLATIONAL MEDICINE(干细胞转化医学)》上的一项研究证实:长期患有2型糖尿病会降低干细胞的增殖能力、免疫抑制潜力及存活率。 ▲健康组(第1组)和2型糖尿病患者的自体骨髓来源间充质干细胞(BM-MSCs)的表征对比(糖尿病持续时间:第2组:<5年,组3:5-10年,第4组:>10年) 尽管干细胞治疗2型糖尿病的具有潜在治疗效果,但一些患者使用自体干细胞进行治疗却得到矛盾的结果,这是由于疾病影响了患者自体干细胞的分子和细胞特征,特别是代谢活动和线粒体DNA的改变。 所以,当你患有糖尿病超过10年且较为肥胖时,采用自体干细胞进行治疗就不会是一个明智的选择。 细胞存活率 我们都知道,当干细胞输入到体内,只有活着的干细胞能真正起到修复或治疗的作用,失活细胞不仅有碍有效性,还可能会引发机体毒性反应。 所以细胞活率不但关乎细胞质量,更涉及人体自身的安全。也正因如此,国内监管对于干细胞产品活率要求较高,通常要≥90%。 除了干细胞本身的活性,其存储和运输条件也至关重要。不合格的存储或运输条件可能导致细胞死亡、细胞膜破裂及内容物释放,这不仅会削弱治疗效果,还可能增加不良事件的发生风险。此外,细胞的移植方式同样影响细胞活率,如输注移植速度过慢、耗时过长,都可能增加细胞死亡的风险,从而提高不良事件发生的可能性。 细胞生长活性 人体会衰老,人体内广泛存在的MSC也会衰老(大自然的规律),体外培养的MSC同样会衰老(复制性衰老)。 细胞生长活性的评定涉及多个标准,如细胞倍增时间、细胞周期、克隆形成率和端粒酶活性等。这些指标均受到“细胞代次”的显著影响。 细胞代次指的是干细胞在体外培养过程中的传代次数。刚从脐带、胎盘等组织提取出来的干细胞是原始P0代,传一代是P1代干细胞,以此类推。在此过程中,干细胞的生物学效力和增殖特性,会随着传代次数的增加逐渐下降。 △图a代表P3代,图b代表P8代 虽然干细胞理论上可以长期传代培养,但衰老干细胞的免疫抑制功能会出现明显的下降,因此在临床应用中不建议选择代次较高的干细胞批次。 但P0代干细胞活性很高,为什么不直接使用它呢?那是因为我们需要综合考虑细胞的剂量与安全性。如果没经过足够的体外培养、扩增,可能导致细胞总数量不够,达不到使用标准。 此外,传代培养的过程还是一个纯化干细胞的过程。刚从组织中被新鲜提取出的P0代干细胞还来不及检测各种污染物的存在情况,也没有进行进一步的净化,有可能存在某些细菌、病毒、微生物等,缺乏安全保障。 目前学界普遍公认,P3、P4、P5代次的干细胞,遗传特性基本稳定,生物学特性虽然有一定的差异,但差异不大,也可以认为基本稳定。所以要同时兼具数量、安全及干细胞活性,P3、P4、P5代次的干细胞是最佳的选择。 总括而言,确保干细胞治疗的质量,必须严格把控三大核心“黄金”指标:细胞来源的可靠性、细胞活性的强度以及细胞存活率的高低。而在实际应用中,还需精准评估最佳细胞剂量、选择适宜的使用方式,并充分考虑患者的个体健康状况等诸多因素,以确保治疗的有效性和安全性。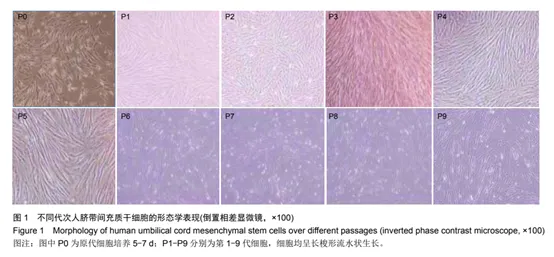

微
信
公
众
号

地址:珠海市横琴新区横琴国际创新中心兴科五巷85号204-205、207、兴科二巷72号301、302、303、304、305、306、307
联系电话:138 2308 5206,150 8810 7345
联系人:酆先生
为您提供专业的服务
THE:138 2308 5206

